安罗替尼作为一种新型多靶点的酪氨酸激酶按捺剂(TKI),可以经由过程肿瘤血管基质重编程、肿瘤细胞重编程和肿瘤免疫微情况重编程三年夜机制来杀伤肿瘤细胞。
下面就让我们一路走近安罗替尼抗肿瘤的第一年夜机制——肿瘤血管基质重编程,其余两年夜机制将在以后为大师具体论述。
肿瘤血管生成是肿瘤发展和转移的要害
我们身体所需要的各类营养都需要经由过程血管来运输。相对正常细胞而言,癌细胞对营养物资的需求更高,细胞割裂需要更多的营养,转移入侵也需要营养,是以肿瘤在产生、成长的进程中会构成年夜量的新生血管,这些新生的血管为肿瘤的发展供给其所需要的营养供给,同时向远处分散肿瘤细胞,在体内分歧部位构成新的转移灶。
1945年Al开云appgire初次提出“肿瘤血管生成”的概念,1971年Folkman进一步提出血管生成与肿瘤发展、转移关系紧密亲密,并可以经由过程按捺血管生成,堵截营养来历,到达按捺肿瘤发展的目标,也就是闻名的“肿瘤饥饿疗法”。该理论的呈现为抗肿瘤血管生成药物供给了研究标的目的和理论根本[1]。
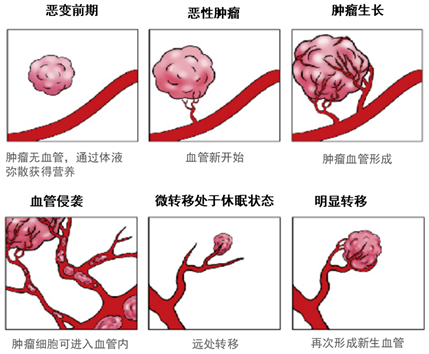
肿瘤血管新生
那末抗肿瘤血管生成药物事实是若何阐扬感化的呢?起首来领会一下肿瘤血管生成的机制
肿瘤血管生成是指在原有血管根本上生成以毛细血管为主的血管系统,并在肿瘤组织内成立血液轮回的进程。肿瘤血管生成受多种促血管生成因子和血管生成按捺因子的调理[2]。
肿瘤组织的血管混乱无章,而且存在年夜量的分支渗漏血管,血管通透性年夜年夜增添。这造成了间质流体压力升高和血液灌注和氧合削减,致使肿瘤组织区域极端缺氧和药物输送不足,就像是漏水的管道,固然源源不竭地往身体输送着药物,但最后达到病灶内的却所剩无几。这些改变反过来又会引发肿瘤进展、加害四周组织、远处转移和化疗难治性[3]。
安罗替尼的肿瘤血管基质重编程感化,除按捺血管新生,堵截肿瘤营养来历以外,还能增进肿瘤血管正常化。加强药物递送,并致使渗漏削减,灌注加强,以禁止肿瘤的进一步恶化。正常化的肿瘤血管系统可使化疗、靶向药物、免疫查抄点按捺剂等的递送获得高度加强,更好地阐扬抗肿瘤感化[3,4]。这就像把方才漏水的管道补缀好,是以输送进身体的药物可以正常并且充足地达到病灶内,充实阐扬感化。
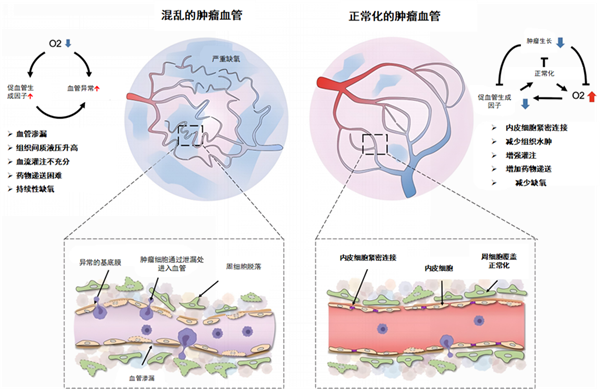
肿瘤血管正常化的示意图
安罗替尼作为我国自立研发的多靶点抗血管药物,是经由过程哪些方式到达按捺肿瘤血管生成,增进血管正常化的抗肿瘤结果呢?
釜底抽薪——安罗替尼有用按捺肿瘤血管新生,堵截肿瘤营养来历
VEGF、PDGF和 FGF是三种首要的促血管生成因子,它们所介导的三条旌旗灯号通路是调控肿瘤血管新生的首要机制[5]。
份子机制研究和动物尝试显示,安罗替尼可同时按捺三种首要的促血管生成因子的受体,VEGFR、PDGFR和 FGFR,经由过程按捺血管构成相干的三条旌旗灯号通路,周全阻断肿瘤血管新生,堵截肿瘤营养来历,而且安罗替尼的按捺感化优在舒尼替尼和索拉非尼等其他药物[6-10]。

安罗替尼经由过程多通路阻断肿瘤血管新生
暗渡陈仓——安罗替尼增进肿瘤血管正常化,增添药物递送
一项切磋安罗替尼对肿瘤细胞影响的动物尝试显示,安罗替尼不但可以显著按捺肿瘤新生血管,还可以改变肿瘤血管基质,增进血管正常化,从而改良血管形态和肿瘤血液灌注,使得血管渗漏削减,缺氧减缓,增进肿瘤间质液压恢复正常,进而增添化疗药物在肿瘤组织散布,进一步增强抗肿瘤结果[11]。
并肩作战——安罗替尼结合EGFR-TKI和化疗等,具有协同增效感化
研究显示,安罗替尼可增添化疗、靶向药物或免疫查抄点按捺剂在肿瘤组织中的散布,是结合其他药物具有协同增效感化的机制之一。
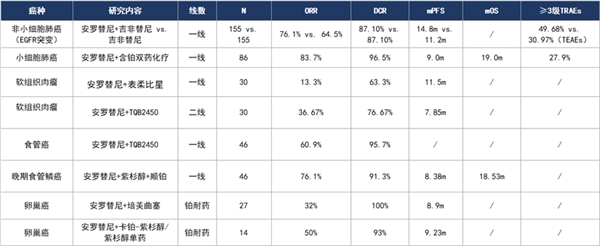
在肺癌[12-16]、软组织赘瘤[17,18]、食管磷癌[19,20]、卵巢癌[21,22]等肿瘤医治中,均有多项研究证实,安罗替尼结合化疗或靶向药物(如吉非替尼、尼拉帕利)可以显著节制肿瘤发展,改良患者保存。
总结:
肿瘤血管生成与肿瘤的发展转移紧密亲密相干,成熟的肿瘤血管基质布局紊乱致使组织极端缺氧,并且药物输送不足;安罗替尼作为多靶点小份子抗血管生成药物,可以经由过程有用按捺VEGF、PDGF、FGF旌旗灯号通路,来按捺肿瘤血管新生;同时增进肿瘤血管的正常化,增添其他抗肿瘤药物递送至肿瘤组织,是以结合化疗、靶向医治、免疫查抄点按捺剂,具有协同增效的感化。
参考文献
[1] 鲁美钰,仲维兰,司春枫等.肿瘤血管生成机制和抗肿瘤血管新生的靶向药物研究进展[J].安徽医药,2018,22(05):798-802.
[2]林国享,朱小东.肿瘤血管生成的增进身分和其在肿瘤产生成长中的感化研究进展[J].广西医学,2020,42(03):334-337+346.
[3]Hellmut G Augustin, et al. Cancer Res. 2022 Jan 1;82(1):15-17.
[4]Jin-Sung Park, et al. Cancer Cell. 2016 Dec 12;30(6):953-967.
[5]姜婧琦,宋雨童,卢育彤等.抗血管生成靶向药物在肿瘤医治中的研究进展[J].山东医药,2022,62(22):86-90.
[6]Xie C, et al. Cancer Sci. 2018;109(4):1207–1219.
[7]Lin B, et al. Gene. 2018 May 15;654:77-86.
[8]Unpublished data from Millipore.
[9]Wilhelm SM, et al. Cancer Res. 2004:64;7099-7109.
[10]Sun, Q. et al. Cancer Biol Ther. 2014;15(12):1635-45.
[11]Su, et al. Clin Cancer Res. 2022 Feb 15;28(4):793-809.
[12]Li Zhang, et al. 2022 ESMO Asia, LBA10.
[13]Tianqing Chu et al. Transl Lung Cancer Res. 2022 Jul;11(7):1394-1404.
[14]Wei Zhang et al. Lung Cancer. 2022 Nov;173:43-4.
[15]Yong Fang, et al. 2022 ESMO 1036P.
[16]Lin Wu, et al. 2022 WCLC EP08.02-158.
[17]Zhou Y, et al. Clin Cancer Res. 2022 Oct 13:CCR-22-1903.
[18]Liu J,Guo W,et al. Clin Cancer Res. 2022 Aug 15;28(16):3473-3479.
[19]Xiuli Yang,et al. Journal of Clinical Oncology 2023 41:4_suppl, 377-377
[20]Junsheng Wang, et al. Journal of Clinical Oncology 2021 39:3_suppl, 181-181.
[21]Chen Jueming, et al. Annals of Oncology (2021) 32 (suppl_5): S725-S772. 10.1016/annonc/annonc703.
[22]D. Miller, et al. Annals of Oncology, Volume 30, Supplement 5, 2019, Page v422,ISSN 0923-7534.
责任编纂:prsky开云app-客户满意是我们服务的宗旨!
联系我们
Copyright © 2009-2025 开云app版权所有 备案号:粤ICP备09100880号-1
地址:深圳市宝安区固戍街道裕兴科技工业园G栋
